食药用菌生物活性物质研究与开发
发布日期:2019/11/1 12:59:11
胡丰林,赵铖
安徽农业大学真菌生物技术教育部工程研究中心
食药用菌泛指可食用或药用或者食药兼用的大型真菌。新中国成立70年来,我国食药用菌产业快速发展,已成为农业领域中仅次于粮、棉、油、果、菜的第六大作物。我国是食药用菌生产大国,产量占世界市场总量的80%以上,其中干鲜菌年生产量占世界总产量的70%以上。根据《2017年我国各种食药用菌产品出口全球的数量统计》我国也是世界上食药用菌资源大国,2016年出版的《中国大型菌物资源图鉴》共记载大型菌物509属1819种,其中食用菌有936种,23变种,3亚种、4变型,药用菌473种,其余近400种大部分也含有一定的生物活性物质。食用菌中生物活性物质赋予了食用菌的保健价值,药用菌中的生物活性物质赋予了药用菌的药用价值,这些生物活性物质可深度开发各类高附加值保健品和药品,这是食药用菌技术创新和产品深度开发的重要方向。下面对食药用菌中一些常见生物活性物质及其开发进行简要论述。
多糖类生物活性物质研究与开发
多糖(polysaccharide)是由10个以上单糖残基通过糖苷键相连而成,其分子结构复杂且相对分子质量较大,广泛存在于植物、动物和真菌中,是细胞生长发育、免疫应答和植物细胞壁的重要组成部分。真菌多糖一般是从真菌子实体、菌丝或者发酵液中通过不同物理和化学方法提取出来的[1-2]。食药用菌多糖多具有各种生物活性,例如抗肿瘤、免疫调节、抗氧化和抗病毒等作用,在国际上真菌多糖被称为生物反应调节物(BRM),目前已开发的产品有:香菇多糖、猪苓多糖、银耳多糖、茯苓多糖、云芝多糖、猴头菇多糖和针裂蹄多糖等等。产品包括:注射剂、胶囊、片剂和口服液等多种,产品附加值高,经济效益显著。随着我国人口老龄化越来越严重,具有免疫调节和抗癌等活性的多糖产品将具有更大市场需求,值得深入研究和产品开发。
我国天然食药用真菌活性多糖资源丰富,但高品质的多糖产品仍然较少,相关产品的开发具有广阔的发展空间,下面将对主要的真菌多糖做一些介绍(见表1)。
表1 部分食药用真菌多糖来源、种类及生物活性[3, 4]
Table1 Sources, composition and bioactivity of natural polysaccharides
多糖 | 来源 | 组成成分 | 主要药理作用 |
灵芝多糖 | Ganoderma lucidum | 葡聚糖、葡萄糖肽 | 降血糖、免疫调节、抗肿瘤、抗衰老 |
黑木耳多糖 | Auricularia aurricula | 葡聚糖 | 降血糖、免疫调节、抗肿瘤、抗辐射 |
猴头多糖 | Hericium erinaceus | 杂多糖 | 免疫调节、抗肿瘤、降血糖 |
银耳多糖 | Tremella fuciformis | 葡聚糖 | 降血脂、免疫调节、抗辐射、抗肿瘤 |
金针菇多糖 | Flammulina velutipes | 葡聚糖、甘露糖 | 抗肿瘤 |
竹荪多糖 | Dictyophora indusiata | 杂多糖、甘露聚糖 | 抗肿瘤、降血脂 |
茯苓多糖 | Poria cocos | 葡聚糖 | 抗肿瘤 |
冬虫夏草多糖 | Cordyceps sp. | 糖甘露糖、葡萄糖 | 免疫调节、抗肿瘤 |
羊肚菌多糖 | Morchella esculenta | 杂多糖 | 降血脂、抗肿瘤 |
裂褶多糖 | Schizophyllium commune | 葡聚糖 | 抗肿瘤 |
香菇多糖 | Lentinus edodes | 甘露葡聚糖、葡聚糖 | 免疫调节、抗肿瘤、抗病毒 |
云芝多糖 | Polystictus versicolar | 葡聚糖、糖肽 | 免疫调节、抗肿瘤、抗辐射、降血脂 |
金耳多糖 | Tremella aurantialba | 杂多糖 | 免疫调节、降血脂 |
姬松茸多糖 | Agaricusblazei | 聚糖 | 降胆固醇、降血糖、抗血栓、抗肿瘤 |
茶树菇多糖 | Agrocybe aegerila | 葡聚糖、甘露聚糖 | 抗衰老、降低胆固醇、抗肿瘤 |
1.1免疫调节作用
绝大多数真菌多糖都具有免疫调节作用。药用真菌多糖对机体免疫的调节作用,主要是通过增强单核巨噬细胞系统、细胞免疫系统和体液免疫系统的功能,以及促进细胞因子产生的作用来提高机体的免疫力[1]。宋佳敏等通过对小鼠进行蝉花多糖灌胃,测定小鼠各生理、生化指标,结果表明,蝉花多糖能提高免疫抑制小鼠的免疫器官指数,提高细胞免疫水平、促进细胞因子分泌,全面发挥对免疫抑制小鼠的免疫系统调节作用[5]。封燕通过实验探究两种蝉花多糖CPA-1和CPB-1对树突状细胞(DC)表型和功能的影响,结果发现,经金蝉花多糖作用后,DC表面MHC-II类分子和共刺激分子(CD80/86、CD11c)的表达显著增加,说明金蝉花多糖CPA-1和CPB-1能够促进DC成熟,从而增强免疫调节功能[6]。胡庭俊等应用反向离子对高效液相色谱法测定小鼠脾脏淋巴细胞PKC活性,探究银耳多糖(TPS)体外对小鼠脾脏淋巴细胞蛋白激酶C(PKC)活性的影响,结果表明TPS能促进体外培养的小鼠脾脏淋巴细胞PKC活性[7]。姬松茸、灰树花、云芝、香菇四种多糖复合使用时,可以显著提高其体内抗氧化活性,提高其体外对SMMC.7721人肝癌细胞的抑制作用,更有效地激活小鼠单核巨噬细胞系统,保护荷瘤小鼠的T淋巴细胞,防止胸腺萎缩,提高机体免疫力[8]。从云芝Coriolus COV-1中分离出来的多糖肽(PSP)在小鼠的乙酸扭体法疼痛模型中结果表明,PSP将乙酸引起的扭体数量减少了92.9%,说明具有止痛作用[9]。猴头菇多糖可明显提高正常小鼠脾细胞的IL-2、IL-6、TNF-α、IFN-γ等细胞因子的分泌、外周血中CD3+、CD4+、CD19+细胞百分比及的比值,还可以明显改善环磷酰胺引起的小鼠非特异性免疫、体液免疫及细胞免疫功能的低下状况[10]。
1.2抗肿瘤作用
多糖的抗肿瘤作用主要是通过两种途径实现的,一是具有细胞毒性的多糖直接杀死了肿瘤细胞;二是作为生物免疫反应调节剂通过增强机体的免疫功能而间接抑制或杀死肿瘤细胞[11]。曹磊通过MTT法对姬松茸、香菇、灰树花和云芝四种多糖及其复合多糖进行了体外抗肿瘤实验,结果表明复合多糖浓度在125-500µg/ml浓度范围内,随着复合多糖浓度的增加,其对肝癌SMMC-7721细胞抑制率升高,在相同剂量下复合多糖能更好地抑制肝癌细胞的生长,且各多糖均能促进小鼠脾淋巴细胞的增殖。体外抗肿瘤实验表明,四种多糖对小鼠S-180腹水瘤细胞均具有抑制作用[8]。逯城宇等采用乙醇分级沉淀的方法从蛹虫草中分离得到三种多糖组分,抗肿瘤实验结果表明,2FPS、4FPS和6FPS对Hela细胞体外增殖的影响与作用时间和给药浓度具有显著的量效关系,其中4FPS对Hela细胞具有较强的抑制作用[12]。宋志强等通过使用不同质量浓度的白僵菌多糖溶液刺激小鼠结肠癌细胞CT26.WT,结果表明白僵菌多糖在0.625-15.000μg/mL的浓度范围内,能够抑制CT26.WT细胞增殖和生长,且抑制效应与白僵菌多糖的浓度成正相关。浓度为2.5μg/mL的白僵菌多糖试验组与空白对照组相比具有极显著性差异(P<0.01)[13]。其他研究表明冬虫夏草多糖对小鼠肝癌细胞(H22)和小鼠S180腹水瘤细胞有明显的抑制作用[14, 15]。
1.3抗氧化作用
机体在生命活动的氧化代谢过程中不断产生各种活性氧自由基(ROS),ROS容易损伤机体内的组织,从而引发各种各样的疾病。抗氧化多糖的作用机理可能有以下两大类型:(1)多糖分子直接作用于自由基。对于脂质过氧化而言,多糖分子可以直接捕获脂质过氧化链式反应中产生的活性氧,阻断或减缓脂质过氧化的进行;对于·OH而言,多糖碳氢链上的氢原子可以与其结合成水,达到清除·OH的目的,而多糖的碳原子则因此成为碳自由基,并进一步氧化形成过氧自由基,最后分解成对机体无害的产物;对于超氧阴离子自由基而言,多糖可与其发生氧化反应,达到清除的目的。(2)多糖分子间接作用于自由基。具体又可以分为两种:一是多糖分子直接作用于抗氧化酶。通过提高体内原有抗氧化酶,如SOD、CAT、GSH-Px等的活性,间接发挥抗氧化作用。二是多糖分子络合产生活性氧所必需的金属离子。多糖结构中的醇羟基可以与产生·OH等自由基所必需的金属离子(如Fe2+、Cu2+等)络合,使羟基自由基的产生受到抑制,进而影响脂质过氧化的启动,最终抑制活性氧的产生[16]。杨岚等通过实验研究了黑木耳、香菇多糖的抗氧化活性。结果表明:黑木耳多糖、香菇多糖都具有一定的体外抗氧化能力,其中香菇多糖具有较强的清除羟基自由基(·OH)和1,1-二苯基-2-三硝基苯肼(DPPH·)的作用;并且黑木耳、香菇多糖也具有一定的体内抗氧化活性,均能不同程度的提高血清和肝脏中超氧化物歧化酶(SOD)活力以及谷胱甘肽过氧化物酶(GSH—Px)活力,可以减少肝脏和血清中丙二醛(MDA)含量,增强心脏过氧化物酶(POD)活力以及减少全脑单胺氧化酶(MAO)活力[17]。周海华等研究了云芝多糖的体外抗氧化效果,结果表明,云芝多糖对O2-·清除作用明显,与Vc接近[18]。
1.3抗病毒作用
多糖对病毒的抗性是通过提高机体免疫调节能力,产生对病毒的抗性。采用体外抗病毒试验测定了杏鲍菇多糖对Ⅰ型单纯疱疹病HSV-1的活性。结果表明杏鲍菇多糖具有很强的抑制-型单纯疱疹病毒的活性[19]。真菌多糖还对多种病毒表现出抑制作用,如艾滋病毒(HIV-1)、单纯孢疹病毒(HSV-1、HSV-2)、巨细胞病毒(CMV)、流感病毒等[20]。
2. 萜类化合物
萜类化合物是指具有(C5H8)n通式以及其含氧和不同饱和的衍生物,可以看成是由异戊二烯或异戊烷以各种方式连结而成的一类天然化合物。萜类化合物在自然界广泛存在于高等植物、真菌、微生物、昆虫、以及海洋生物。萜类化合物是中草药中的一类比较重要的化合物,已经发现许多化合物是中草药中的有效成分,同时它们也是一类重要的天然香料,是化妆品和食品工业不可缺少的原料。从大型真菌中分离得到
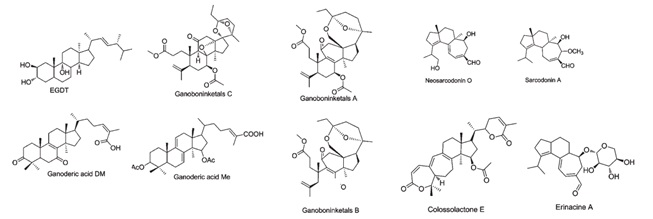
图1 几种具有生物活性的萜类化合物[21]
Fig. 1 Several terpenoids with biological activity
的萜类化合物种类众多,目前报道的有单萜、倍半萜、二萜和三萜类化合物,它们通常具有多种重要的药理活性,例如抗肿瘤、抗炎症和抗菌等多种功效。目前已有灵芝等食药用菌的含萜类活性物质的提取物及其复方保健品生产,但尚无食药用菌萜类纯品药物上市,仍需加大力度进行有关产品开发研究。
2.1抗肿瘤作用
萜类化合物在适宜浓度下可以损伤肿瘤细胞的细胞膜结构,导致膜的崩解,亦可引起蛋白质交联过度而使酶失活,因此其对癌细胞有直接的细胞毒作用,能够直接损伤甚至杀死肿瘤细胞。灵芝三萜组分GLA对人肝癌细胞株SMMC-7721、人早幼粒白血病细胞株HL60和人Burkitt淋巴瘤细胞株CA46有较强抑制作用,对人肝癌细胞株HepG2、人结肠癌细胞株SW480、人慢性粒细胞白血病细胞株K562和人胃癌细胞株SGC-7901也有一定的抑制作用;体内实验表明,GLA在高剂量2g/kg小鼠H22肝癌细胞、小鼠S180肉瘤细胞及裸小鼠Colon26结肠癌细胞生长有一定抑制作用[22]。郑琳等采用MTT观察活性灵芝三萜对癌细胞的生长抑制作用,结果表明灵芝三萜能够抑制各种癌细胞的生长并能诱导细胞发生凋亡[23]。茯苓三萜抗人肝癌细胞HepG2作用机制进行了研究,处理后的HepG2细胞,其形态发生明显的变化,细胞数量减少,可见致密浓染,颜色有些发白的细胞核,说明茯苓三萜具有较强的诱导肝癌细胞凋亡作用[24]。
2.2抗炎作用
生物活性物质对炎症的作用机理主要是通过作用于细胞内的一氧化氮(NO)和其他炎性介质(如白介素(IL1β,IL-6,IL-8),肿瘤坏死因子(TNF-α)和前列腺素E2(PGE2),从而减轻炎症[25]。Cai TG等从茯苓中分离得到8种三萜类化合物,在体外生物测定中,这些分离的化合物以剂量依赖性的方式从脂多糖(LPS)诱导的原代264.7细胞中产生一氧化氮(NO),其中29-羟基多聚肉豆蔻酸、多聚肉豆蔻酸表现出最大的抑制活性。对两种化合物预处理的细胞进行进一步的检测显示,抑制NO释放是由于iNOS(诱导型一氧化氮合酶)酶的表达减少,这可能通过阻断活化蛋白1来调节信号途径[26]。Deng Jeng-Shyan等对牛樟芝中的两种萜类化合物Eburicoic acid (TR1) 和dehydroeburicoic acid (TR2)进行了抗炎实验,结果表明Tr1和Tr2在Carr注射后第五小时内明显减轻了丙二醛(MDA)、一氧化氮(NO)、肿瘤坏死因子(TNF-α)和白细胞介素-1β(IL-1β)水平[27]。
2.3抗菌作用
抗菌活性是指能够抑制真菌、细菌等微生物在宿主体内生长和繁殖。Wang, Yaqi等从金针菇中分离了三种倍半萜2,5-cuparadiene-1,4-dione、enokipodins B和D。生物活性筛选表明,化合物5-9对枯草芽孢杆菌有一定的抗菌活性和对人肿瘤细胞系(HepG2,MCF-7,SGC7901和A549)的中等细胞毒性[28]。从三种担子菌(coltricia perennis(l)murrill,onnia tomentosa(fr.)p.castle.和polyporus mori(pollini)fr.)的子实体中分离到的萜类化合物,并测量了其抗菌活性,其中从Coltricia perennis(L)Murrill中分离出的萜类化合物对5种细菌的生长抑制作用最强,该化合物对金黄色葡萄球菌的生长抑制最大,对Micrococcus roseus的抑制率最小。从Onnia tomentosa and Polyporus mori中分离得到的萜类化合物对供试细菌的生长也有抑制作用[29]。
除此之外,真菌萜类化合物还具有抗氧化活等性。Wang YQ等利用大米发酵金针菇并从中分离得到倍半萜类化合物,DPPH 自由基清除实验结果表明其中4种化合物有抗氧化活性[28]。
3.蛋白质及肽类
食药用菌中蛋白质及肽类含量非常高,且氨基酸种类齐全,一般含有人体所需的8种必需氨基酸,属于优质蛋白质来源。按干重计算,食用菌中的蛋白质含量一般在15-30%之间。在一些食用菌中,还含有一些具有含有免疫和抗氧化功能的活性蛋白和多肽。研究表明蛹虫草含有丰富的蛋白质,部分甚至高达39%,其中人体必需氨基酸的种类齐全、比例适当,占氨基酸总量的 35. 47%[30]。高燕红等测定了冬菇、姬松茸、干枞菌、云耳、银耳、岩耳6种食用菌的氨基酸含量,其必需氨基酸接近人体必需氨基酸的要求模式,表明6种食用菌蛋白质含量丰富,必需氨基酸基本齐全且与人体必需氨基酸的要求模式接近,是优质蛋白质食品[31]。赵爽等使用蛹虫草蛋白质提取物处理人肝癌HepG2细胞、人乳腺癌MCF-7细胞和人肺腺癌A-549细胞72h后,IC50值分别为10μg/mL,14μg/mL,8μg/mL,并且抑制率均随时间延长和浓度的增加而增加;显微镜下可观察细胞凋亡形态的改变,表明该提取物具有一定的抗肿瘤功效[32]。目前报道的一些具有活性功能的蛋白类物质见下表。
表2 已知食用菌中具免疫调节功能蛋白类物质[20]
Table 2 Proteins with immunomodulatory function in edible fungi
名称 | 来源 | 功能 |
LZ-8 | 赤灵芝 | 可凝集羊、鼠的血红细胞,促进淋巴细胞增殖,抗肿瘤、抗过敏 |
Fipgts | 松杉灵芝 | 免疫调节,抗肿瘤 |
Gmi | 小孢灵芝 | 免疫调节,抗肿瘤 |
Fip-fve | 金针菇 | 可凝集人的4种血细胞,促进淋巴细胞增殖,抗肿瘤、抗过敏 |
Fip vvo/vvl | 草菇 | 免疫调节 |
APP | 毛木耳 | 免疫调节,抗肿瘤、抗过敏 |
PLG-3a | 桑黄菌丝体 | 抗肿瘤 |
AAL(凝集素) | 茶树菇 | 抗肿瘤 |
4 核苷类
虫草素是一种脱氧核苷类似物,具有抗肿瘤、抗白血病、抗菌、抗衰老、免疫调节和清除体内自由基等多种药理作用,对多种疾病尤其是恶性肿瘤具有明确的治疗作用。虫草素在细胞内有多个作用靶标,可调控肿瘤细胞生长、增殖和转移等过程。虫草素发挥抗肿瘤的作用机制包括抑制嘌呤、DNA和RNA合成及蛋白质翻译,诱导肿瘤细胞凋亡和调控细胞周期,抗肿瘤细胞侵袭,抑制血小板凝集和抗炎5个途径及其相应的信号通路[33]。李婧研究了国产虫草素对小鼠迟发型超敏反应,结果表明注射虫草素后,对迟发型超敏反应引起的小鼠接触性皮炎发挥明显的抑制效应,同时对脾脏组织未见明显毒性作用[34]。卢群等通过体外实验,探讨虫草素诱导肿瘤细胞凋亡的新靶点,对虫草素作用人肝癌 Bel-7402 细胞后的抑制和凋亡及 p53、Bcl-2 表达变化进行研究,虫草素可明显抑制 Bel-7402 细胞增殖,且诱导凋亡,其机制是上调 p53、下调 Bcl-2,促进细胞凋亡达到抗肿瘤细胞的效果[35]。
腺苷(Ado)为虫草素的直接前体物质[36],是一种嘌呤核苷, 通过与细胞膜上相应的G蛋白耦联受体(A1、 A2A、 A2B和A3)结合,调节免疫细胞(中性粒细胞、巨噬细胞与树突细胞及淋巴细胞等)的分化成熟与迁移及细胞因子、趋化因子的释放, 从而调节局部与全身炎症反应[37]。有研究表明腺苷可通过与特异的嘌呤受体 A3也可抑制中性粒细胞的粘附与迁移而发挥一定的抗炎作用[37, 38]。
N6-(2-羟乙基)-腺苷通过与α受体结合抑制了神经递质释放而产生镇痛作用,其镇痛机理不同于目前常用的阿片类镇痛剂,不具有成瘾性,使用安全,并用小白鼠醋酸扭体法测知其镇痛率高达99%[39]。另外,N6-(2-羟乙基)-腺苷具有抗肾衰竭的作用。柴一秋等通过实验探究了N6-(2-羟乙基)-腺苷对小鼠肾脏缺血再灌注损伤的保护作用,结果显示腹腔注射应用N6-(2-羟乙基)-腺苷能明显降低肾脏缺血再灌注损伤后血清肌酐和尿素氮水平[40]。
5. 其它生物活性物质
食药用菌中还含有甾醇类、鞘氨醇类、多酚类等多种生物活性物质,具有抗肿瘤、预防心血管疾病和降血糖等的作用。易承学采用MTT法测定金针菇甾醇的抗肿瘤活性,结果显示对养人肝癌细胞HepG2、胃腺癌细胞SGC、胶质瘤细胞U251、肺腺癌细胞A549四种肿瘤细胞有较强的抑制作用,甾醇体外抑制HepG2、SGC、U251和A549增殖的IC50为9.29、11.99、23.85和20.44 µg/mL[41]。甾醇类物质是冬虫夏草主要活性成分之一,其中麦角甾醇是真菌特征甾醇,具有显著的抗癌活性[42]。
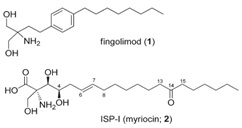
图2 蝉花中多球壳菌素及其开发的药物结构
Fig. 2 Structures of myriocin and the developed medicine fingolimod
目前开发药物较为成功的鞘氨醇类生物活性物质有从蝉花虫草中发现的多球壳菌素(Myriocin)。该活性物质最初是日本人从蝉花虫草中发现,后将多球壳菌素结构改造成Fingolimod(见图2),其生物活性进一步加强,并最终开发成上市药物芬戈莫德。该药物为首个防止淋巴细胞从淋巴结中离开的鞘氨醇1-磷酸盐受体调节剂类药,降低多发性硬化症患者疾病复发的频率,延缓多发性硬化症患者的病情恶化程度。它还可以保持淋巴结内特定的免疫细胞,防止它们作用于中枢神经系统并造成损害,并且对淋巴细胞的保持力是可逆的,从而使患者在治疗停止后体内循环的淋巴细胞恢复到正常水平。目前该药的市场价约为四百万元人民币每千克,是黄金价格的十倍以上,经济价值十分可观。
食药用菌被利用的历史已有数千年,一直只知其然不知其所以然,随着现代科学技术的出现,食药用菌愈加受到大家的重视,而其中的活性物质作为其“灵魂”,越来越多的科学家开始着手于研究其化学结构和作用机制,目前已经围绕食药用菌开发出了一系列保健品和药物,但是作为食药用菌资源大国,我国对于食药用菌资源的开发一直处于起始阶段,高技术高附加值产品少,利润并不丰厚。随着我国科技的发展,高科技和高附加值产品的开发,必将成为我国食药用菌行业发展的重要内容。
参考文献
[1] 翁梁, 温鲁, 药用真菌多糖研究进展[J], 食品科学, 2008, 29(12):748-751.
[2] 王云普, 王永峰, 马君义, 植物多糖的研究概况[J], 中华实用中西医杂志, 2003(12):1835-1838.
[3] 陈传红, 金卫根, 李荣同,包水明, 真菌多糖药理作用研究进展[J], 时珍国医国药, 2006,17(6):933-934.
[4] 肖建辉, 蒋侬辉, 梁宗琦, 刘爱英, 食药用真菌多糖研究进展[J], 生命的化学, 2002,22(2):148-151.
[5] 宋佳敏, 王鸿飞, 罗洁, 单科开,李艳霞, 金蝉花多糖对小鼠免疫功能的影响[J], 核农学报, 2018, 32(10):111-117.
[6] 封燕, 金蝉花多糖的结构特征及免疫活性初步研究[D], 江苏大学, 2016.
[7] 胡庭俊, 梁纪兰, 程富胜, 陈炅然, 银耳多糖对小鼠脾脏淋巴细胞蛋白激酶C活性的影响[J], 中草药, 2005,36(1):81-84.
[8] 曹磊, 四种真菌多糖抗氧化和抗肿瘤及免疫调节活性的研究[D], 郑州大学, 2010.
[9] Chan S L, Yeung J H K, Polysaccharide peptides from COV-1 strain of Coriolus versicolor induce hyperalgesia via inflammatory mediator release in the mouse[J], Life Sciences, 2006,78(21):2463-2470.
[10] 柳璐, 猴头菇多糖对小鼠免疫调节作用的实验研究[D], 广州中医药大学, 2012.
[11] 明建, 云南特有食药用菌活性多糖研究[D], 西南大学, 2008.
[12] 逯城宇, 张尊凯, 刘艳, 张小蕾, 张毅君, 滕利荣, 蛹虫草N102多糖提取条件优化及其抗肿瘤活性研究[J], 食品工业科技, 2012,33(14):250-254.
[13] 宋志强, 丁祥, 朱淼, 唐 贤, 侯怡铃, 白僵菌多糖对肿瘤细胞及免疫细胞作用的研究[J], 2019(7):187-188.
[14] 陈露, 安利国, ChenLu, AnLiguo, 虫草多糖的免疫调节作用及其抗肿瘤活性的研究[J], 山东师范大学学报(自然科学版), 2009,24(4).
[15] 方晓娜, 中国被毛孢菌丝体多糖提取、结构表征及抗肿瘤活性研究[D], 天津科技大学, 2015.
[16] 苗元振, 张红燕, 薛宏伟, 贾乐, 食药用真菌多糖抗氧化作用研究进展[J], 生物技术通报, 2008(S1):30-33.
[17] 杨岚, 邱树毅, 卢卫红, 真菌多糖的抗氧化活性研究[J], 贵州师范大学学报(自然版), 2017,35(35):99.
[18] 周海华, 马海乐, 云芝多糖的体外抗氧化活性研究[J], 食品研究与开发, 2008,29(3):44-48.
[19] 迟桂荣, 徐琳, 吴继卫, 邢建欣, 杏鲍菇多糖的抗病毒、抗肿瘤研究[J], 青岛农业大学学报(自然科学版), 2006,23(3):174-176.
[20] 顾可飞, 周昌艳, 邵毅, 食用菌活性物质开发利用现状[J], 中国食用菌, 2016,35(6):1-9.
[21] 李兆坤, 王凤寰, 陈彬, 蒋思萍, 大型真菌萜类化合物活性研究进展[J], 天然产物研究与开发, 2017(02):179-191.
[22] 魏晓霞, 李鹏, 许建华, 蒋思萍, 灵芝三萜组分GLA体内外抗肿瘤作用的研究[J], 福建医科大学学报, 2010,44(6):417-420.
[23] 郑琳, 黄荫成, 灵芝菌丝体活性三萜抗肿瘤活性的研究[J], 农产品加工(学刊), 2006(8):92-93.
[24] 昝俊峰, 茯苓三萜类成分抗肿瘤活性研究与茯苓药材质量分析[D], 湖北中医药大学, 2012.
[25] Taofiq O, Martins A, Barreiro M F,Ferreira, Isabel C F R, Anti-inflammatory potential of mushroom extracts and isolated metabolites[J], Trends in Food Science & Technology, 2016,50:S1006191381.
[26] Cai T G, Cai Y, Triterpenes from the fungus Poria cocos and their inhibitory activity on nitric oxide production in mouse macrophages via blockade of activating protein-1 pathway.[J], Chemistry & Biodiversity, 2011,8(11):2135-2143.
[27] Jeng-Shyan D, Shyh-Shyun H, Tsung-Hui L, Min-Min Lee, Ching-Chuan Kuo, Ping-Jyun Sung,Wen-Chi Hou,Guan-Jhong Huang, Yueh-Hsiung Kuo, Analgesic and anti-inflammatory bioactivities of eburicoic acid and dehydroeburicoic acid isolated from Antrodia camphorata on the inflammatory mediator expression in mice[J], Journal of Agricultural & Food Chemistry, 2013,61(21):5064-5071.
[28] Wang Y, Bao L, Yang X, Li, Li Li, Shaifei Gao, Hao Yaob, Xin Sheng Liua, Hong Wei. Bioactive sesquiterpenoids from the solid culture of the edible mushroom Flammulina velutipes growing on cooked rice[J], Food Chemistry, 2012,132(3):1346-1353.
[29] Ghosh S K. Isolation of polysaccharides and terpenoids from some basidiomycota and their antibacterial activities.[J], British Microbiology Research Journal, 2014,4(2):155-166.
[30] 李晨曦, 范青生, 姜兴华, 余宙, 蛹虫草蛋白质的碱法提取工艺[J], 食品与发酵工业, 2012,38(12):185-188.
[31] 高燕红, 鲁琳, 刘应亮, 6种食用菌蛋白质与氨基酸的含量分析及评价[J], 现代预防医学, 2010,37(10):1843-1846.
[32] 赵爽,刘宇,许峰,陈杰,杨娟娟,王守现,耿小丽,王兰青,殷昭坤, 蛹虫草蛋白质提取物及其抗肿瘤的应用[p] .
[33] 王多, 鲍荣, 王芳, 胡永红, 柴惠霞, 虫草素抗肿瘤作用分子机制研究进展[J], 中国药理学与毒理学杂志, 2015,29(4):643-650.
[34] 李婧, 国产虫草素(cordycepin)抗小鼠迟发型超敏反应的实验研究[D], 华中科技大学, 2006.
[35] 卢群, 罗少洪, 何伟彬, 梅文杰, 虫草素对人肝癌Bel-7402细胞抑制及作用机制的研究[J], 中国药理学通报, 2011,27(10):1477.
[36] 李祝, 刘爱英, 梁宗琦, 虫草菌素的生物活性及检测方法[J], 食用菌学报, 2002,9(1):57-62.
[37] 万萍, 陈昊, 白爱平, 腺苷的免疫调节功能[J], 世界华人消化杂志, 2014(17):2379-2384.
[38] Matt B, Devika S, Burton V J, Tammy, Wilson,Ruth Pearson,Watson Robert P, Philip Smith, Parkinson Scott J, Impairment of adenosine A3 receptor activity disrupts neutrophil migratory capacity and impacts innate immune function in vivo[J], European Journal of Immunology, 2012,42(12):3358-3368.
[39] 徐红娟, 莫志宏, 余佳文,朱华李,毛先兵, 蝉花生物活性物质研究进展[J], 中国药业, 2009,18(4):19-21.
[40] 柴一秋, 彭秀秀, 朱碧纯, 金秩伟, N6-(2-羟乙基)腺苷在抗肾衰竭中的用途[p]
[41] 易承学, 金针菇抗肿瘤活性成分筛选及其纳米制剂研究[D], 江苏大学, 2012.
[42] 郑林, 中国被毛孢甾醇提取最优条件的正交法研究[D], 上海师范大学, 2011.
下一篇:食药用菌重金属调查分析