等离子体诱变灵芝技术及光谱筛选方法研究
发布日期:2019/11/1 11:59:45
黄青1,*,马玉涵1,2,姚国华1, 何华奇2, 张倩倩1
1.中国科学院合肥物质科学研究院
2.安徽科技学院
*通讯作者:huangq@ipp.ac.cn
摘要:作为富含多种药理成分的药用菌及传统中药材,灵芝自古以来就受到广泛的重视。为了进一步提高现有赤灵芝的有效活性成分,可以对其进行诱变选育。低温等离子体作为一种新型高效的诱变手段,在灵芝育种中得到了应用,由此可以获得丰富的突变种质资源。另一方面,在灵芝育种研究中还需要发展对突变菌株快速有效鉴别分析及筛选的方法,这也是目前研究的热点和难点。本文介绍了近年来我们应用低温等离子技术进行灵芝诱变育种方面的工作,以及关于应用红外光谱方法对诱变灵芝品种进行品质分析及光谱筛选方法的探索。
一、前言
灵芝是一种药用真菌,具有补气安神、扶正固本等功效。它是我国传统中药,历史悠久,并已收录于多个国家的现代医学药典。一般认为赤灵芝的多糖和三萜是其主要的药用成分。因此,如果能提高灵芝多糖和灵芝三萜的含量,将对灵芝产业发展有重要意义。但是野生灵芝菌种资源有限,需要进一步进行菌株选育和人工栽培,所以构建大量突变体库并配合以大规模筛选措施势在必行。目前,已有许多学者开展这方面的研究,如Peng 等用氯化锂和Triton X-100诱变灵芝原生质体,通过筛选得到的突变体株,其胞内多糖和灵芝三萜含量分别提高了568.45%和373.43%[1]。Yeong等对神舟1号上搭载经太空诱变的灵芝菌株采用光谱方法进行分析[2]。邓春梅等对我国返回式卫星上搭载的灵芝菌种进行了栽培实验,发现其中的卫星灵芝2号在菌丝生长速度和菌丝体中氨基酸含量、子实体产量和质量等多个指标上均有所提高[3]。张银萍等利用紫外线和NTG复合诱变灵芝原生质体,选育获得萌发速度快、长势旺盛的菌株[4]。董玉玮等利用氯化锂、EMS和亚硝酸盐对灵芝原生质体进行诱变,并通过筛选得到了灵芝多糖含量高的菌株[5]。Wei等对微生物菌种库的灵芝菌株进行比较,筛选得到发酵条件下的灵芝多糖和三萜含量高的菌株[6]。最近,Hao等对灵芝进行了CRISPR-Cas9基因编辑操作,实现了对灵芝中ura3标记基因的敲除[7]。但是,他们研究发现,对于其它缺乏选择性表型基因的敲除操作却有困难,其中困难之一是缺乏标记基因从而制约了基因编辑后的菌株的筛选。所以,对于灵芝等高等真菌而言,高效的诱变手段配合有效的筛选方法是育种成功的关键。
二、等离子体诱变技术在微生物育种中的应用
虽然基于预先设计的基因工程方法已成为某些微生物菌种改良的首要手段,但在许多情况下,基于物理/化学诱变技术的随机诱变手段仍然是十分重要的,特别是在某些基因操作手段存在技术或非技术困难的情况下,这种诱变方法就会展示出其特有的优势。相比于其它物理或化学诱变手段,低温等离子体(LTP:low-temperature plasma)则是一种行之有效的物理-化学复合诱变方法。等离子体是除固态、液态、气态外的物质第四态,人工获得方法是在两个电极之间加高电压,当达到击穿电压时,电极间的气体分子就被电离,产生了电子和离子混合的气体,即:等离子体。一般条件下,放电过程中虽然电子温度很高,但重离子温度低,则整个体系温度不高(通常比环境室温略高),相对于太阳那样呈现的高温等离子体状态来说,它因此被称为低温等离子体。低温等离子体与物质作用方式比较复杂,而且作用产生的物质成分也很丰富。等离子体作用于水或含水物质可以产生羟基、活性氧自由基等物质具有较强的氧化性,所以当它作用于生物分子如蛋白质、DNA分子时可引起分子损伤,而当它作用于细胞中的DNA时,如果细胞修复损伤的DNA而出错,则有可能引起变异。因此LTP技术可以用于诱变育种。LTP诱变方法有许多优点,它操作简单,易于控制,突变率较高,并且无化学诱变和放射性诱变存在的环境污染和潜在风险,也不需要太空诱变所需要的复杂设备和资金投入,是一种特别适合广泛使用的诱变手段。
如今,LTP诱变技术在多种微生物诱变中都得到广泛应用[8]。例如,对于细菌诱变,研究人员LTP技术处理的细菌涵盖了大肠杆菌(Escherichia coli)[9]、巴氏醋酸杆菌(Acetobacter pasteurianus)[10]、谷氨酸棒状杆菌(Corynebacterium glutamicum)[11]、产气肠杆菌(Enterobacter aerogenes)[12]、阴沟肠杆菌(Enterobacter cloacae)[13]等革兰氏阴性菌,也包括枯草芽孢杆菌(Bacillus subtilis)[14,15]等革兰氏阳性菌。Wang等利用LTP结合亚硝酸钠处理大肠杆菌,获得了反式-4-羟基-L-脯氨酸高产菌株,在5L发酵罐中发酵48h,该菌株的产量达到了25.4 g/L[16]。Liu等利用LTP处理ldhA和pflB缺陷型大肠杆菌菌株B002,原菌株在厌氧条件下无法利用葡萄糖,但经诱变处理,LL016的突变体恢复细胞生长和葡萄糖利用能力,并在发酵120小时后,利用35.0g/L葡萄糖产生了25.2g/L的琥珀酸[17]。Wang等对转有L-赖氨酸诱导启动子(该启动子控制和表达绿色荧光蛋白)的大肠杆菌进行LTP处理,通过对突变体库荧光激活细胞的筛选和后续复选,获得2株突变高产菌株,其L-赖氨酸浓度和含量分别提高21.00和9.05%,18.14%和10.41%[18]。Li等利用射频大气压辉光放电(也是一种LTP放电方式)作用于甲状毛孢菌(Methylosinus trichosporium),获得突变体其生长速度和单加氧酶活性菌有明显提高[19]。Dong等通过LTP和细胞固定化来提高假单胞菌对底物的耐受性,经过筛选,获得的突变菌株mut-D3,其最适底物浓度由100 mm提高到150 mm,产物烟酸积累达到189 g/L,比野生型(WT)提高42%[20]。在丝状真菌诱变方面,LTP诱变技术也得到了广泛应用。例如,Shi等对黑曲霉(Aspergillus niger)合成葡萄糖酸进行LTP诱变处理,结果得到3个诱变株,其葡萄糖酸产率提高了12.1%、15.5%和32.8%[21]。Zhu 等同样对黑曲霉进行LTP诱变处理,诱变后菌株淀粉酶活性提高70%,达到2.2×103U/ml[22]。Qiang等利用LTP诱变技术处理三孢布拉霉菌(Blakeslea trispora),使其合成番茄红素的水平提高55%,达到每克干物质26.4mg水平[23]。Qin 等对丝状真菌(Glarea lozoyensis)进行LTP诱变处理,以提高其合成纽莫康定B0(Pneumocandin B0)的能力,通过诱变获得菌株合成量提高1.39倍,达到1134mg/L[24]。Li等对高山被孢霉(Mortierella alpina)进行LTP诱变处理,其合成的花生四烯酸相对浓度达到45.64%,最高产量达到6.82g/L[25]。
三、红外光谱筛选技术在诱变育种中的应用
通过等离子体诱变技术的各种物理和化学诱变方式,可以获得大量的突变菌株。但是,如何从这些突变株中把目的性状的突变株筛选出来,这是诱变育种的关键问题之一,历来都是一项耗时耗力、难度很高的工作。现在,通过基因组工程设计和构建技术,可以获得大量不同的微生物菌株,并对基因型进行探索[26],但是对这些突变体进行表型认识及筛选也同样是一个瓶颈制约问题。一般来说,在筛选过程中,对于缺乏显色或荧光特性的分子,往往用色谱或质谱进行定量分析[27]。现在,随着自动化技术水平不断提高,依赖于仪器的筛选效率可以大大提高。但是,这不仅需要大量资金投入,最终还是需要选择和建立对突变菌株合适的筛选和分析方法[27]。特别若是对微生物产物代谢途径不甚了解,则常用的筛选分析方法可能就难以发挥作用。比如,对于灵芝多萜的分析,有研究表明,灵芝属中可能有多达316种的三萜类化合物,而这些化合物之间为结构类似物或互为代谢衍生物[28]。目前我们对这些代谢途径的了解还非常浅,仅仅对少数化合物如灵芝酸A、灵芝酸T等的代谢的部分途径有所认识[29]。如何对这些物质进行快速、准确分析从而实现突变菌株筛选,这就需要发展新的筛选分析方法。
光学-光谱学方法可以对微生物的代谢产物及代谢过程进行快速、实时、无损观测与分析,因此可能为解决诱变育种筛选问题提供有效的检测与分析工具[30]。现在,把光谱技术应用于生物研究是一种趋势,我们课题组多年来也一直致力于发展生物光谱技术[31,32]。生物光谱是利用生物分子或基团的发射、吸收或散射光谱特征来确定物质的组成、性质、结构及含量,并对生物性质及过程进行探测分析的技术[30]。生物光谱技术具有很多优点,包括:1)可对生物样品(包括生物分子、细胞、个体)进行实时、动态、无损检测;2)可实现多化学组分同时快速检测与分析;3)操作简便、样品用量少、获得信息量大。
在微生物研究方面,红外光谱(IR:infrared spectroscopy)技术已有较广泛的应用[8,33]。特别是傅里叶变换红外光谱技术(FT-IR:Fourier transform infrared spectroscopy),可以应用于微生物品种的鉴定和分类[34,35],即利用红外光谱的指纹谱区,可对不同的菌株进行鉴别和聚类分析。FT-IR技术还可用于对微生物发酵过程的动态检测和分析[36],而这一技术有利于对诱变菌种的生产过程的实时定性定量监控,也可能用于菌种传代稳定性的研究。FT-IR方法也可用于微生物在胁迫作用下的生理生化检测[37],这对研究微生物筛选中常用的抗性筛选或营养缺陷性的机理研究十分重要。除此之外,红外光谱在成像方面的应用也可用于观测微生物的生长和变化过程,从而用于诱变育种领域[32,33]。例如,利用FT-IR微成像技术,可实现对微生物生长发育各环节的细胞内组分含量及时空分布的动态研究,从而有利于对突变菌株的代谢突变位点和机制予以更加精确的判断分析[38]。Melin等利用FT-IR技术对经γ射线辐照处理的微球菌进行检测,观测到辐照后引起的细胞脂质过氧化过程、蛋白质和糖类发生的修饰过程以及DNA的骨架被破坏[39]。我们课题组应用红外光谱显微成像技术观测了单细胞雨生红球藻虾青素代谢过程[40]。特别地,我们应用生物光谱技术在诱变菌株选育方面也开展了一系列的研究工作[41-45]。例如,我们应用红外光谱和拉曼光谱对雨生红球藻LTP诱变株进行分析[41-44]。利用LTP诱变技术,我们对雨生红球藻进行诱变处理,获得了大量正突变菌株(通过单克隆藻细胞的分离和生长速率的测定,将生长速率超过出发株20%定义为正突变藻株),并对这些突变株的虾青素含量进行测定,发现了虾青素产量高于出发株的M3、M14和M29的雨生红球藻正突变藻株,其中的M3藻株的雨生红球藻虾青素的产量3.35%w/w,为出发株WT(2.11%w/w)的1.59倍。利用红外光谱可以很容易将正突变株与出发株区分开来,并且基于近红外光谱数据我们构建了虾青素含量分析的定量模型[41-43],其准确可靠性甚至可与常规定量方法相比较。以下分别介绍我们在低温等离子体诱变灵芝技术和光谱筛选分析方法上所做的一些研究工作。
四、等离子体诱变灵芝技术和光谱筛选分析方法
1、利用等离子体诱变灵芝原生质体获得多糖含量高的诱变菌株[46]
为了实现有效的LTP诱变,我们自己搭建了介质阻挡等离子体放电(DBD)发生装置,并利用这个装置对灵芝原生质体进行诱变。我们实验用的灵芝是赤灵芝(Ganoderma lucidum)。实验装置如图1所示,我们设计的LTP诱变设备产生等离子体是通过介质阻挡放电(DBD:dielectric barrier discharge)方式,放电电源采用纳秒脉冲高压电源,放电气体可以采用氩气、氮气等,由气表控制流量注入自制的圆柱形容器,内置石英反应皿,注入灵芝原生质体溶液,上方固定可调节高度的电极,电极连接高压纳秒脉冲直流电。LTP放电效果可通过气体种类、气体流量和电压强度等调控。在灵芝诱变实验中,我们需要优化LTP放电实验条件。实验中采用的工作气体:He气,放电电压:13kV,气流量:2L/min,放电4min。

图1介质阻挡(DBD)低温等离子体(LTP)发生装置示意图
利用LTP诱变灵芝原生质体之后,我们用RAPD(random amplified polymorphic DNA)即随机扩增多态性DNA标记对处理过的原生质体进行初步分析,即用它可以检测是否有DNA的改变从而判断是否诱变产生[41]。通过多次RAPD检测,我们排除了假阴性和假阳性情况,从而确定了LTP诱变菌株。同时,我们通过硫酸蒽酮方法[47]测量灵芝多糖含量,考察诱变株多糖含量的改变。结果如图2所示。
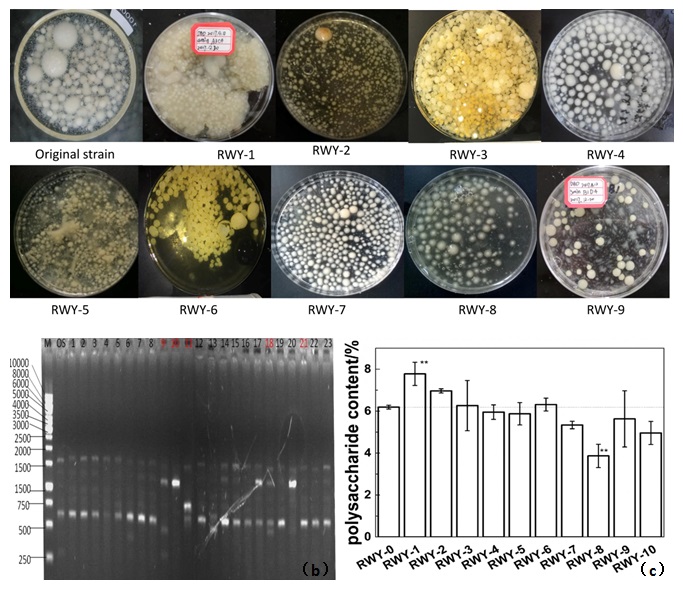
图2 诱变灵芝菌株状态。(a)不同诱变灵芝菌丝球的表观形态;(b)部分LTP诱变菌株RAPD电泳图;(c)部分诱变菌株多糖含量比较
由图2可以看出,诱变灵芝菌株菌丝球大小、形态、颜色、生长速度、生物量等存在着比较明显的差别。利用多个引物组进行RAPD电泳分析,部分诱变菌株的电泳条带与OS出发株出现了显著的差异,确定是发生突变的菌株。这些突变株相比于出发株,其灵芝多糖含量也有了很大差异。RWY-1、RWY-2、RWY-3和RWY-6平均多糖含量高于出发株;RWY-4、RWY-5、RWY-7、RWY-8、RWY-9和RWY-10平均多糖含量低于出发株。RWY-1和RWY-8多糖含量与出发株相比有显著差异。可以看到,经过LTP诱变技术处理,部分菌株的多糖含量与出发株相比有了显著改变。
2、利用红外光谱方法鉴别多糖含量高的诱变菌株[48]
我们通过LTP得到大量灵芝诱变突变株。为了对这些诱变株进行筛选分析,一方面我们在研究中继续采用传统的测量方法,对这些菌株的灵芝多糖和三萜含量进行测量和分析,另一方面,我们也在建立和发展基于光谱的分析方法,以便于发展新的诱变育种筛选工具与手段。这里主要介绍我们对灵芝菌丝体红外光谱进行研究的工作。
红外光谱可以表征分子特定功能基团以及整个分子结构的各种特征。生物体作为复杂的系统,主要由水、脂肪、蛋白质、碳水化合物和其他成分组成。在生物机体中这些组分的含量、组成、分子结构及分子内和分子间的相互作用,赋予了生物体有别于其它物体的光谱学性质。因此中红外光谱既可以提供结构-功能关系的信息,又可以作为化学成分定量分析的工具[34]。近红外光谱是由红外中的基本振动跃迁的倍频和组合频构成的,其吸收系数一般比中红外光谱低10~10000倍。因此,与中红外光谱不同,近红外光谱需要采集大量光谱,主要用于生物样本的定量分析,而其中一个关键步骤是建立一个校正集模型,常用的化学计量学方法包括多元校正技术,如最小二乘法(PLS)、多元线性回归(MLR)、主成分回归(PCR)、局部加权回归(LWR)等[42,44]。
在红外光谱测量分析的实验中,我们将发酵后的出发株和诱变株的灵芝菌丝体清洗后冷冻干燥,研成粉末状过筛备测。根据红外光谱波段可以分为中红外(mid-IR,谱区范围为4000-200 cm-1)和近红外(near-IR或NIR, 谱区范围为12500~4000cm-1)测量。在中红外光谱检测中,我们把样品压片置于Bruker Alpha-T红外光谱仪中光谱扫描。扫描范围:4000-400cm-1,分辨率4cm-1,扫描64次,OPUS 7.0数据处理软件收集结果并分析。在近红外光谱检测中,我们把灵芝菌丝体制成粉末,用德国布鲁克公司MPA型近红外光谱仪采集其近红外漫反射光谱,波数范围为12500-400cm-1,设置光谱分辨率为16cm-1,扫描32次。平行检测2次取平均光谱分析。记录的典型光谱如图4所示。
图4 灵芝菌丝体的红外光谱(包括中红外和近红外光谱)检测流程示意图
(1)灵芝菌丝体的中红外(mid-IR)特征性光谱
典型的灵芝干燥菌丝体和诱变灵芝菌丝体的FT-IR光谱测量结果如图6a所示,其典型峰位位于1425 cm-1 [49,50]、1316 cm-1 [51]、1152 cm-1 [52]、1078 cm-1 [53]、1025 cm-1 [54,55]和951 cm-1[55,56]等位置均有比较清晰的吸收峰,归属情况见表1。
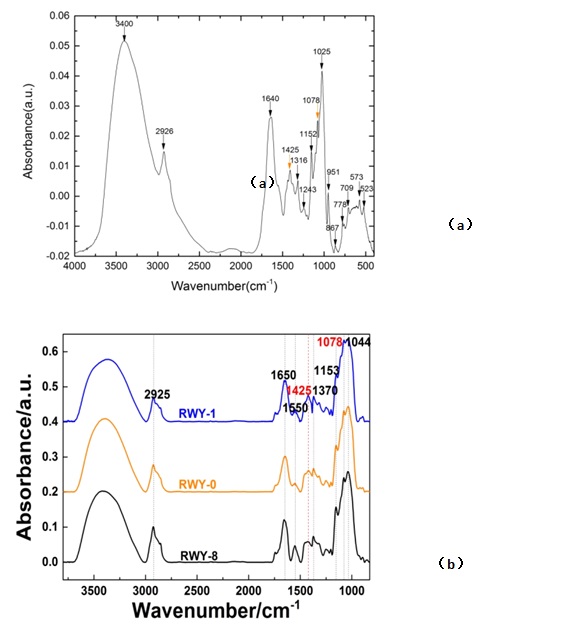
图6 (a)典型的灵芝菌丝体的红外光谱;(b)不同诱变灵芝菌株红外光谱比较(多糖含量不同)
表 1 灵芝干燥菌丝体中红外特征光谱归属
波数(cm-1) | 基团归属 |
3400 | -OH 伸缩振动[57] |
2926 | CH2非对称伸缩振动[58] |
1640 | 酰胺 I[58] |
1457 | 多糖中的-CH2[59] |
1425 | 木质素和碳水化合物中的C-H变形振动[49,60] |
1372 | 面内弯曲振动C-H [61,62] |
1314-1316 | 纤维素中-CH2弯曲振动[51] |
1243 | 面内-COH/CH弯曲振动[61] |
1152-1156 | 糖苷键C-O-C非对称伸缩振动[52] |
1078 | β-糖苷键C-O伸缩振动[50,53,54] |
1044 | C-O-C基团伸缩振动[63] |
1025 | α-糖苷键C-O伸缩振动[54,55] |
951 | β-糖苷键 [55]; C-O 和 C-C 伸缩振动[56] |
867 | γ (C-H)[64]; 呋喃环[65] |
778 | COO- 变形振动[66] |
709 | CH面外弯曲[67] |
573 | 多糖环弯曲振动[68] |
523 | 吡喃环[65] ; C=O非对称变形振动[69] |
为了鉴别中红外光谱中与灵芝多糖的特征光谱,我们还对含不同灵芝多糖的灵芝样品进行光谱比较和分析。从中红外光谱中,我们可以识别出碳水化合物的特征带(图6a),即在1425 cm-1和1078 cm-1处谱峰,它们在多糖含量较高的样品中相对强度较强(图6b)。
(2)近红外光谱(NIR)测定灵芝菌丝体中多糖的含量
为了进行灵芝多糖定量分析,我们还收集大量不同灵芝菌株对之进行近红外光谱测量。灵芝干燥菌丝体的典型近红外光谱如图7a所示,其中8403 cm-1,6896 cm-1,5155 cm-1处的吸收峰归属为水,而在4307 cm-1,4405 cm-1,5787 cm-1和5935 cm-1处的吸收峰属于碳水化合物吸收峰。近红外光谱特征谱的详细归属参见表2。我们利用近红外光谱数据可以构建其多糖含量的定量模型,通过比较,我们发现当选取的光谱范围如图8(a)和(b)所示,预处理方法为一阶导数,得到灵芝菌丝多糖定量模型较好。作为校正集,在维数=6时,其定量模型的决定系数R2=0.9779,交叉验证均方根(RMSECV)=0.467,残留预测偏差值(RPD)=6.73,结果如图8(c)所示。我们利用该定量模型对LTP诱变获得的灵芝菌株进行定量分析,结果如其RMSEP=0.445,相关系数=0.9684,结果如图8(d)所示。

图 7(a) 灵芝干燥菌丝体近红外光谱定量模型选择区段;(b)选择区段一阶导数;(c)76个菌株构建的校正集;(d)DBD诱变菌株预测集
表 2 灵芝菌丝体近红外光谱归属
波数 (cm-1) | 光谱归属 | 主要来源(s) |
8403 | O-H伸缩振动的一级倍频和O-H弯曲振动的组合频 (2ν1,3+ν2) | 水[70] |
6896 | 水 [70] | |
6674 | O-H伸缩振动的一级倍频 | |
6307 | O-H伸缩振动的一级倍频 | 醇或水[70] |
5935 | C–H伸缩振动的一级倍频 | 木质素[71], 半纤维素 [71, 72] |
5787 | -CH2中C–H的一级倍频 | 碳水化合物 [73] |
5155 | 水中O-H伸缩振动和变形振动的组合频 | 水 [74] |
4719 | O-H 和 C-O 伸缩振动的组合频 | 多糖 [75] |
4405 | O-H 伸缩振动和 C-O伸缩振动的组合频 | 多糖 [76] |
4307 | C-H 伸缩振动和C-H2变形振动的组合频 | 多糖 [70] |
4021 | C-H伸缩振动和 C-C伸缩振动的组合频 | 纤维素 [70] |
这里补充说明一下关于灵芝多糖近红外光谱分析和定量模型的合理性和可靠性。对于灵芝多糖含量高低不同菌株在4307 cm-1和4405 cm-1处近红外光谱峰位有比较显著的差异,如图8(a)所示。而我们的量化模型涵盖了5268.8-4000 cm-1的光谱范围,其中包括在4307和4405 cm-1这两处特征性峰位,这两个峰位对应着中红外的1425和1078 cm-1峰位。而1425和1078 cm-1峰位分别对应于葡聚糖吡喃环的C-H弯曲和C-O-H弯曲振动,葡聚糖广泛存在于不同种类的真菌中[77]。具体而言,1078 cm-1是木质素和碳水化合物的β-葡聚糖的C-O伸缩振动[50],这与近红外光谱中的4405 cm-1相对应,因为4405 cm-1是由O-H的伸缩振动和C-O伸缩振动的组合频。1425 cm-1峰位对应于木质素和碳水化合物中的C-H的变形振动[49],这与近红外光谱中的4307 cm-1峰有关,这是由于C-H伸缩振动和CH2变形振动组合而成。为了进一步验证这一点,我们还计算了中红外光谱和近红外光谱的二维相关光谱,由此验证灵芝菌丝体多糖近红外光谱和中红外光谱之间的关系,结果如图8(b)所示。由图中看到,近红外光谱范围(5268.8~4000 cm-1)与中红外光谱(1422~1376 cm-1)的相关性最强,这正是来自灵芝多糖成分的贡献。
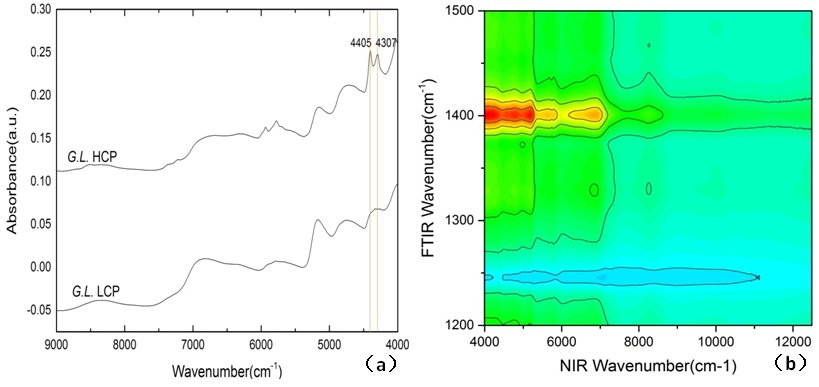
图8 (a)灵芝多糖含量高(G.L. HCP)低(G.L.LCP)菌株近红外光谱;(b)灵芝菌株中红外和近红外2D相关光谱
(3)红外光谱及拉曼光谱技术在灵芝三萜分析中的应用
另一方面,对于灵芝三萜成分及含量的测量与分析,我们也采用光谱分析方法做了一些探索性的工作[78,79]。灵芝三萜种类多而复杂,鉴别起来相对比较困难。以往研究中,关于灵芝三萜显色分析方法可能存在一些问题,对此我们做过一些探讨[80]。
对于光谱研究工作,我们需要得到易于光谱分析各种灵芝三萜标准样品。一般三萜可从灵芝子实体中提取;但在液体发酵条件下,灵芝菌丝也会产生一定量的灵芝三萜,只是不同菌株菌丝体灵芝三萜含量有所不同。一般来说,利用HPLC分析,我们可以灵芝三萜进行初步分析,可以看到,不同菌株的灵芝三萜含量差异很大,结果如图9所示,其中如G058和G009显著高于G080。
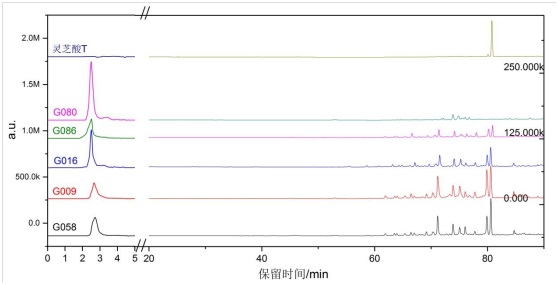
图9 HPLC测量不同灵芝菌丝体中三萜含量
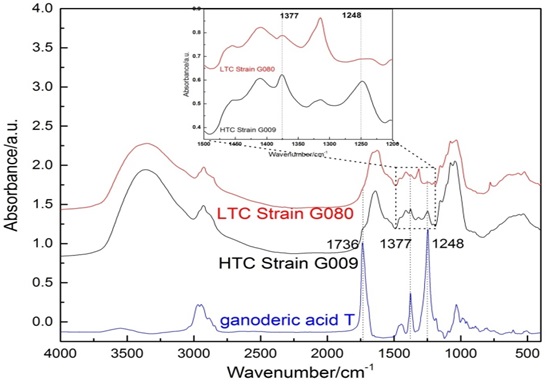
图10 不同三萜含量的灵芝菌株的红外光谱比较
进一步可以用各种提纯制备各种三萜纯品,以便于寻找三萜光谱特征峰。我们比较了G009与G080的中红外光谱,如图10所示。将灵芝菌丝体中三萜含量高低不同的菌株与灵芝酸T的红外光谱对比,我们发现其中的特征性峰位分别位于1736、1377和1248cm-1。其中1736 cm-1对应着C=O伸缩振动,1377 cm-1对应于CH3中C-H对称弯曲振动,1248 cm-1对应于C-H面内振动。从图中可以看出,三萜含量高的菌株G009在上述峰位比G080更为明显。这些光谱峰位对灵芝菌丝体中三萜含量定性分析中有重要作用,但要具体分析这些光谱,还需要对光谱进行详尽的理论计算。最近,我们对不同灵芝酸的中红外和拉曼光谱峰位进行了DFT计算,详细分析计算了不同种类灵芝酸的特征性峰位和光谱特征[79]。但是因为三萜种类很多,各种灵芝菌株三萜种类及含量也存在很大差异,所以关于灵芝三萜更为系统的光谱研究工作还在进行之中。
五、展望
灵芝作为传统的药用菌中草药材,具有其灵芝多糖和三萜是已知的药效成分。为了提高灵芝菌株的灵芝药用成分,可以采用低温等离子体等诱变方式对原始出发株进行诱变处理,从而获得大量突变体库,并从中筛选灵芝多糖、三萜或其它有效成分含量高的菌株,由此丰富灵芝的种质资源,达到优良品种选育的目的。我们研究表明,把低温等离子体技术和光谱技术有机结合起来,这是一种行之有效的途径。目前,在低温等离子体技术研究方面,除了优化诱变参数以外,还需要对真菌诱变机理进一步研究。在光谱研究方面,一方面要与传统分析方法互为验证,另一方面要通过理论计算进行光谱解析。在红外光谱应用方面,可以把中红外和近红外光谱技术结合起来,主要利用中红外可以定性分析,利用近红外进行定量建模,这对于发展品种质量快速鉴别和筛选、建立炮规标准可能非常有用,具有很好的应用和发展前景。此外,红外光谱还可以结合拉曼光谱建立灵芝药用成分的定性和定量分析模型。例如,在三萜分析方面,我们可以利用拉曼光谱分析和鉴别不同三萜种类,进一步建立基于光谱技术的产品分析和检验标准。总之,我们这项研究不仅有利于灵芝育种,而且还可以推广到其它食用菌和药用菌,例如对紫芝、牛樟芝、桑黄等近源药用丝状真菌进行等离子体诱变及光谱筛选,以期获得更好的品种,以推动我国食药用真菌育种业的发展。
参考文献
[1] PENG R, FU Y Z, ZOU J, et al. Improvement of polysaccharide and triterpenoid production of Ganoderma lucidum through mutagenesis of protoplasts [J]. Biotechnol Biotechnol Equip, 2016, 30(2): 381-387.
[2] CHOONG Y K, CHEN X D, JAMAL J A, et al. Preliminary Results of Determination of Chemical Changes on Lingzhi or Reishi Medicinal Mushroom, Ganoderma lucidum (W.Curt.:Fr.)P. Karst. (Higher Basidiomycetes) Carried by Shenzhou I Spaceship with FTIR and 2D-IR Correlation Spectroscopy [J]. International Journal of Medicinal Mushrooms, 2012, 14(3): 295-305.
[3] 邓春海, 黄廷钰, 冀宝嬴,等. 太空诱变对灵芝菌株特性的影响 [J]. 食用菌, 1999, 05): 9-10.
[4] 张银萍, 张舒, 汪洋,等. 灵芝原生质体的高效制备及诱变 [J]. 安徽农业科学, 2012, 40(25): 12379-12381.
[5] 董玉玮, 苗敬芝, 曹泽虹,等. 灵芝原生质体化学诱变育种 [J]. 食品研究与开发, 2012, 33(06): 166-170.
[6] WEI Z H, DUAN Y Y, QIAN Y Q, et al. Screening of Ganoderma strains with high polysaccharides and ganoderic acid contents and optimization of the fermentation medium by statistical methods [J]. Bioprocess and Biosystems Engineering, 2014, 37(9): 1789-1797.
[7] HAO Q, HAN X, ZOU G, et al. CRISPR-Cas9 assisted gene disruption in the higher fungus Ganoderma species [J]. 2017, 56(57-61.
[8] OTTENHEIM C, NAWRATH M, WU J C. Microbial mutagenesis by atmospheric and room-temperature plasma (ARTP): the latest development [J]. Bioresources and Bioprocessing, 2018, 5(1): 1-14.
[9] MA J F, WU M K, ZHANG C Q, et al. Coupled ARTP and ALE strategy to improve anaerobic cell growth and succinic acid production by Escherichia coli [J]. Journal of Chemical Technology & Biotechnology, 2016, 91(3): 711-717.
[10] WU X, WEI Y, XU Z, et al. Evaluation of an Ethanol-Tolerant Acetobacter pasteurianus Mutant Generated by a New Atmospheric and Room Temperature Plasma (ARTP) [J]. Journal of Bacteriology, 2015, 187(13): 4671.
[11] CHENG G, XU J, XIA X, et al. Breeding L-arginine-producing strains by a novel mutagenesis method: Atmospheric and room temperature plasma (ARTP) [J]. Prep Biochem Biotechnol, 2015, 46(5): 509-516.
[12] LU Y, WANG L, MA K, et al. Characteristics of hydrogen production of an Enterobacter aerogenes mutant generated by a new atmospheric and room temperature plasma (ARTP) [J]. Biochemical Engineering Journal, 2011, 55(1): 17-22.
[13] HUA X, WANG J, WU Z, et al. A salt tolerant Enterobacter cloacae mutant for bioaugmentation of petroleum- and salt-contaminated soil [J]. Biochemical Engineering Journal, 2010, 49(2): 201-206.
[14] MA Y, YANG H, CHEN X, et al. Significantly improving the yield of recombinant proteins in Bacillus subtilis by a novel powerful mutagenesis tool (ARTP): Alkaline α-amylase as a case study [J]. Protein Expr Purif, 2015, 114(82-88.
[15] FAN X, WU H, LI G, et al. Improvement of uridine production of Bacillus subtilis by atmospheric and room temperature plasma mutagenesis and high-throughput screening [J]. Plos One, 2017, 12(5): e0176545.
[16] WANG J X, ZHANG Z Y, LIU H D, et al. Construction and optimization of trans-4-hydroxy-L-proline production recombinant E-coli strain taking the glycerol as carbon source [J]. Journal of Chemical Technology and Biotechnology, 2016, 91(9): 2389-2398.
[17] LIU R M, LIANG L Y, MA J F, et al. An engineering Escherichia coli mutant with high succinic acid production in the defined medium obtained by the atmospheric and room temperature plasma [J]. Process Biochem, 2013, 48(11): 1603-1609.
[18] WANG Y, LI Q G, ZHENG P, et al. Evolving the L-lysine high-producing strain of Escherichia coli using a newly developed high-throughput screening method [J]. Journal of Industrial Microbiology & Biotechnology, 2016, 43(9): 1227-1235.
[19] LI H P, WANG Z B, GE N, et al. Studies on the Physical Characteristics of the Radio-Frequency Atmospheric-Pressure Glow Discharge Plasmas for the Genome Mutation of Methylosinus trichosporium [J]. Ieee Transactions on Plasma Science, 2012, 40(11): 2853-2860.
[20] DONG T T, GONG J S, GU B C, et al. Significantly enhanced substrate tolerance of Pseudomonas putida nitrilase via atmospheric and room temperature plasma and cell immobilization [J]. Bioresource Technology, 2017, 244(1104-1110.
[21] SHI F, TAN J, CHU J, et al. A qualitative and quantitative high-throughput assay for screening of gluconate high-yield strains by Aspergillus niger [J]. Journal of Microbiological Methods, 2015, 109(134-139.
[22] ZHU X, ARMAN B, CHU J, et al. Development of a method for efficient cost-effective screening of Aspergillus niger mutants having increased production of glucoamylase [J]. Biotechnology Letters, 2017, 39(5): 1-6.
[23] WANG Q, FENG L R, WEI L, et al. Mutation Breeding of Lycopene-Producing Strain Blakeslea Trispora by a Novel Atmospheric and Room Temperature Plasma (ARTP) [J]. Applied Biochemistry and Biotechnology, 2014, 174(1): 452-460.
[24] QIN T T, SONG P, WANG X T, et al. Protoplast mutant selection of Glarea Lozoyensis and statistical optimization of medium for pneumocandin B-0 yield-up [J]. Bioscience Biotechnology and Biochemistry, 2016, 80(11): 2241-2246.
[25] LI X Y, LIU R J, LI J, et al. Enhanced arachidonic acid production from Mortierella alpina combining atmospheric and room temperature plasma (ARTP) and diethyl sulfate treatments [J]. Bioresource Technology, 2015, 177(134-140.
[26] HAIMOVICH A D, MUIR P, ISAACS F J. Genomes by design [J]. Nature Reviews Genetics, 2015, 16(9): 501-516.
[27] LIN J L, WAGNER J M, ALPER H S. Enabling tools for high-throughput detection of metabolites: Metabolic engineering and directed evolution applications [J]. Biotechnology Advances, 2017, 35(8): 950-970.
[28] XIA Q, ZHANG H, SUN X, et al. A comprehensive review of the structure elucidation and biological activity of triterpenoids from Ganoderma spp [J]. Molecules, 2014, 19(11): 17478-17535.
[29] XU J W, ZHAO W, ZHONG J J. Biotechnological production and application of ganoderic acids [J]. Applied Microbiology & Biotechnology, 2010, 87(2): 457.
[30] 刘京华. 基于生物光谱对等离子体诱变雨生红球藻机理及突变体快速筛选方法的研究 [D]; 中国科学技术大学, 2016.
[31] 黄青,光谱在生物学研究中的应用 [J]. 安徽大学学报(自然科学版),2012,36(1):6-17.
[32] 刘京华,黄青. FT-IR 光谱在电离辐射作用于微生物研究中的应用 [J].生物物理学报,2012,28(9):1-12.
[33] 余增亮, 王纪, 袁成凌, 等. 微生物油脂花生四烯酸产生菌离子束诱变和发酵调控 [J]. 科学通报,2012,57(11):883-890.
[34] SANTOS C, FRAGA M E, KOZAKIEWICZ Z, et al. Fourier transform infrared as a powerful technique for the identification and characterization of filamentous fungi and yeasts [J]. Research in Microbiology, 2010, 161(2): 168-175.
[35] FISCHER G, BRAUN S, THISSEN R, et al. FT-IR spectroscopy as a tool for rapid identification and intra-species characterization of airborne filamentous fungi [J]. Journal of Microbiological Methods, 2006, 64(1): 63-77.
[36] BURATTINI E, CAVAGNA M, DELL’ANNA R, et al. A FTIR microspectroscopy study of autolysis in cells of the wine yeast Saccharomyces cerevisiae [J]. Vibrational Spectroscopy, 2008, 47(2): 139-147.
[37] CORTE L, RELLINI P, ROSCINI L, et al. Development of a novel, FTIR (Fourier transform infrared spectroscopy) based, yeast bioassay for toxicity testing and stress response study [J]. Analytica Chimica Acta, 2010, 659(1–2): 258-265.
[38] HOLMAN H Y, WOZEI E, LIN Z, et al. Real-time molecular monitoring of chemical environment in obligate anaerobes during oxygen adaptive response [J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(31): 12599.
[39] MELIN A M, PERROMAT A, DELERIS G. Sensitivity of Deinococcus radiodurans to γ-Irradiation: A Novel Approach by Fourier Transform Infrared Spectroscopy [J]. Archives of Biochemistry & Biophysics, 2001, 394(2): 265-274.
[40] 刘京华,黄青. 应用红外光谱显微成像技术观测单细胞雨生红球藻虾青素代谢过程 [J].光散射学报,2014,,26(3):321-325.
[41] LIU J, CHEN J, CHEN Z, et al. Isolation and characterization of astaxanthin-hyperproducing mutants of Haematococcus pluvialis (Chlorophyceae) produced by dielectric barrier discharge plasma [J]. Phycologia, 2016, 55(6): 650-658.
[42] LIU J, HUANG Q. Screening of Astaxanthin-Hyperproducing Haematococcus pluvialis Using Fourier Transform Infrared (FT-IR) and Raman Microspectroscopy [J]. Applied Spectroscopy, 2016, 70(
[43] LIU J H, SONG L, HUANG Q. Rapid screening astaxanthin-hyperproducing Haematococcus pluvialis mutants through near infrared spectroscopy [J]. Letters in Applied Microbiology, 2016, 62(2): 185-191.
[44] 刘京华, 陈军, 秦松,等. 红外光谱在微藻领域的应用研究进展 [J]. 光谱学与光谱分析, 2019, 39(01): 79-86.
[45] 王纯阳, 马玉涵, 刘斌美,等. 近红外透反射光谱测定单粒稻种的蛋白质含量 [J]. 核农学报, 2019, 33(10): 2003-2012.
[46] MA Y H, ZHANG Q Q, ZHANG Q F, et al. Improved production of polysaccharides in Ganoderma lingzhi mycelia by plasma mutagenesis and rapid screening of mutated strains through infrared spectroscopy [J]. Plos One, 2018, 13(9):
[47] SKALICKA-WOZNIAK K, SZYPOWSKI J, LOS R, et al. Evaluation of polysaccharides content in fruit bodies and their antimicrobial activity of four Ganoderma lucidum (W Curt.: Fr.) P. Karst. strains cultivated on different wood type substrates [J]. Acta Societatis Botanicorum Poloniae, 2012, 81(1): 17-21.
[48] MA Y, HE H, WU J, et al. Assessment of Polysaccharides from Mycelia of genus Ganoderma by Mid-Infrared and Near-Infrared Spectroscopy [J]. Scientific Reports, 2018, 8(1): 1-10.
[49] NAUMANN A, NAVARRO-GONZALEZ M, PEDDIREDDI S, et al. Fourier transform infrared microscopy and imaging: detection of fungi in wood [J]. Fungal Genet Biol, 2005, 42(10): 829-835.
[50] KOZARSKI M, KLAUS A, NIKSIC M, et al. Antioxidative and immunomodulating activities of polysaccharide extracts of the medicinal mushrooms Agaricus bisporus, Agaricus brasiliensis, Ganoderma lucidum and Phellinus linteus [J]. Food Chemistry, 2011, 129(4): 1667-1675.
[51] GHEBRESELASSIE H. Measuring the hydrophobicity of cellulose and the effect of humidity by inverse gas chromatography [J]. Dissertations & Theses - Gradworks, 2013,
[52] TANGSADTHAKUN C, KANOKPANONT S, SANCHAVANAKIT N, et al. The influence of molecular weight of chitosan on the physical and biological properties of collagen/chitosan scaffolds [J]. J Biomater Sci Polym Ed, 2007, 18(2): 147-163.
[53] CHEN X, LIU X, SHENG D, et al. Distinction of broken cellular wall Ganoderma lucidum spores and G. lucidum spores using FTIR microspectroscopy [J]. Spectrochim Acta A Mol Biomol Spectrosc, 2012, 97(667-672.
[54] CARRASCO H, ESPINOZA L, CARDILE V, et al. Eugenol and its synthetic analogues inhibit cell growth of human cancer cells (part I) [J]. Journal of the Brazilian Chemical Society, 2008, 19(3): 543-548.
[55] LIU G, SONG D S, ZHAO D Z, et al. A study of the mushrooms of boletes by Fourier transform infrared spectroscopy [M]//BALLY G V, LUO Q. Ico20: Biomedical Optics. 2006.
[56] MURESAN A E, MUSTE S, VLAIC R A, et al. HPLC Determination and FT-MIR Prediction of Sugars from Juices of Different Apple Cuhivars during Fruit Development [J]. Notulae Botanicae Horti Agrobotanici Cluj-Napoca, 2015, 43(1): 222-228.
[57] OJAMAE L, HERMANSSON K, PROBST M. THE OH STRETCHING FREQUENCY IN LIQUID WATER SIMULATIONS - THE CLASSICAL ERROR [J]. Chemical Physics Letters, 1992, 191(5): 500-506.
[58] ZHANG F, HUANG Q, YAN J, et al. Assessment of the Effect of Trichostatin A on He La Cells through FT-IR Spectroscopy [J]. Analytical Chemistry, 2015, 87(4): 2511-2517.
[59] XUE Q, PENG W X, OHKOSHI M. Molecular bonding characteristics of Self-plasticized bamboo composites [J]. Pakistan Journal of Pharmaceutical Sciences, 2014, 27(4): 975-982.
[60] ZHU X L, CHEN A F, LIN Z B. Ganoderma lucidum polysaccharides enhance the function of immunological effector cells in immunosuppressed mice [J]. Journal of Ethnopharmacology, 2007, 111(2): 219-226.
[61] GOO B G, BAEK G, CHOI D J, et al. Characterization of a renewable extracellular polysaccharide from defatted microalgae Dunaliella tertiolecta [J]. Bioresource Technology, 2013, 129(343-350.
[62] SHAO L, WU Z J, ZHANG H, et al. Partial characterization and immunostimulatory activity of exopolysaccharides from Lactobacillus rhamnosus KF5 [J]. Carbohydrate Polymers, 2014, 107(51-56.
[63] ZHAO T, MAO G H, FENG W W, et al. Isolation, characterization and antioxidant activity of polysaccharide from Schisandra sphenanthera [J]. Carbohydrate Polymers, 2014, 105(26-33.
[64] GRUBER J, LI R W C, PONCE P, et al. Novel soluble blue emitting PPV-like polymers: synthesis and characterization [J]. E-Polymers, 2003,
[65] ETCHEVERRY S B, WILLIAMS P A M, BARAN E J. Synthesis and characterization of oxovanadium(IV) complexes with saccharides [J]. Carbohydrate Research, 1997, 302(3-4): 131-138.
[66] PETROSYAN A M. Vibrational spectra of L-histidine perchlorate and L-histidine tetrafluoroborate [J]. Vibrational Spectroscopy, 2007, 43(2): 284-289.
[67] DEFREES D J, MILLER M D, TALBI D, et al. THEORETICAL INFRARED-SPECTRA OF SOME MODEL POLYCYCLIC AROMATIC-HYDROCARBONS - EFFECT OF IONIZATION [J]. Astrophysical Journal, 1993, 408(2): 530-538.
[68] CHOONG Y K, SUN S Q, ZHOU Q, et al. Determination of storage stability of the crude extracts of Ganoderma lucidum using FTIR and 2D-IR spectroscopy [J]. Vibrational Spectroscopy, 2011, 57(1): 87-96.
[69] VARETTI E L, AYMONINO P J. Ir Spectra of Perfluoromethyl Perfluoroacetate and Perfluoromethyl Carbonate [J]. Journal of Molecular Structure, 1971, 7(1-2): 155-&.
[70] WORKMAN J, WEYER L. Practical Guide to Interpretive Near-Infrared Spectroscopy [M]. CRC Press, Inc., 2007.
[71] FERREIRA D S, POPPI R J, PALLONE J A L. Evaluation of dietary fiber of Brazilian soybean (Glycine max) using near-infrared spectroscopy and chemometrics [J]. Journal of Cereal Science, 2015, 64(43-47.
[72] FACKLER K, SCHWANNINGER M, GRADINGER C, et al. Qualitative and quantitative changes of beech wood degraded by wood-rotting basidiomycetes monitored by Fourier transform infrared spectroscopic methods and multivariate data analysis [J]. FEMS Microbiol Lett, 2007, 271(2): 162-169.
[73] HE W, HU H. Prediction of hot-water-soluble extractive, pentosan and cellulose content of various wood species using FT-NIR spectroscopy [J]. Bioresource Technology, 2013, 140(299-305.
[74] CHEN Y, DENG J, WANG Y, et al. Study on discrimination of white tea and albino tea based on near-infrared spectroscopy and chemometrics [J]. J Sci Food Agric, 2014, 94(5): 1026-1033.
[75] CHEN J-B, SUN S-Q, ZHOU Q. Data-driven signal-resolving approaches of infrared spectra to explore the macroscopic and microscopic spatial distribution of organic and inorganic compounds in plant [J]. Analytical and Bioanalytical Chemistry, 2015, 407(19): 5695-5706.
[76] CHEN S F, DANAO M G, SINGH V, et al. Determining sucrose and glucose levels in dual-purpose sorghum stalks by Fourier transform near infrared (FT-NIR) spectroscopy [J]. J Sci Food Agric, 2014, 94(12): 2569-2576.
[77] MOHACEK-GROSEV V, BOZAC R, PUPPELS G J. Vibrational spectroscopic characterization of wild growing mushrooms and toadstools [J]. Spectrochim Acta A Mol Biomol Spectrosc, 2001, 57(14): 2815-2829.
[78] He H, Yao G, Ma Y, et al. Experimental and theoretical study of the Raman spectra of ganoderic acid T [J]. J. Structural Chemistry. 2019. 60(9):1467-1480.
[79] YAO G H, MA Y H, MUHAMMAD M, et al. Understanding the infrared and Raman spectra of ganoderic acid A: An experimental and DFT study [J]. Spectrochimica Acta Part a-Molecular and Biomolecular Spectroscopy, 2019, 210(372-380.
[80] 张倩倩,黄青. 基于香草醛-高氯酸显色反应测定灵芝三萜的方法探讨与修正[J]. 菌物学报,2018, 37(12): 1792-1801.
下一篇:即食型绿茶双孢菇格拉条的研制